慢病毒转染在CRISPR-Cas9系统中的重要意义,附实验步骤解析
推动生物技术领域的创新发展在生物技术领域,慢病毒转染的 CRISPR - Cas9 系统成为了创新的强大引擎。它广泛应用于基因敲除、插入以及修饰等研究中,帮助科学家们构建各种基因工程细胞系和动物模型,用于药物筛选、细胞治疗以及生物制药等方面的研究。例如,通过精确编辑细胞的代谢通路相关基因,可提高生物制品的生产效率;在动物模型构建中,能够快速模拟动物**状态,加速药物研发进程。
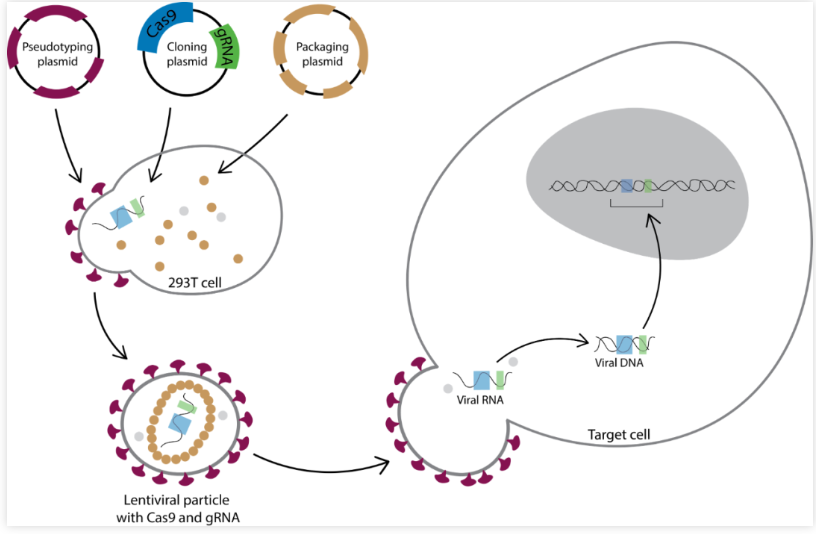
CRISPR慢病毒转染法是一种高效引入CRISPR基因编辑系统到目标细胞中的技术,旨在实现对基因的有针对性编辑或调控。
实验步骤:
1、质粒构建:构建好含有CRISPR-Cas9系统的质粒,其中包括lentiCRISPR-sgRNA。该质粒携带sgRNA序列,可指导Cas9蛋白准确识别并切割目标基因(之前已详细描述过)。
2、慢病毒包装质粒:准备慢病毒包装质粒,其中包括pCMV-VSV-G(携带包膜蛋白)和pCMV-dR8.2 dvpr(携带包装蛋白)。这两者协同作用,使得慢病毒能够高效地传递CRISPR-Cas9系统到目标细胞内。
3、细胞培养:使用适宜的培养基培养目标细胞,通常选择293T细胞,以确保细胞处于佳的生长状态。
4、转染试剂准备:在进行转染前,将培养基更换为适用于阳离子脂质体转染的Opti-MEM减血清培养基。同时,准备转染试剂,包括Lipofectamine 3000、助转剂P3000以及含有CRISPR-Cas9系统的质粒。
5、转染操作:将质粒混合物与转染试剂按照试剂盒的推荐比例进行混合,随后滴加到目标细胞上。此过程中,确保混合物与细胞充分接触,有利于转染效率的提高。
6、培养条件:将细胞置于37 ℃、5% CO2的培养箱中,培养一定的时间,通常在48小时内。
7、收获:收集细胞上清液,通过离心去除细胞残渣。
8、滤膜过滤:使用0.22 μm孔径的聚醚砜滤膜过滤细胞上清液,以去除残留的细胞碎片和其他杂质。
9、慢病毒收获:得到的慢病毒上清液即为经过纯化和感染活性验证的慢病毒,可用于后续实验中对目标细胞进行感染(若病毒感染效率低,可使用试剂盒进行浓缩病毒)。
10、慢病毒感染:将目的细胞接种于 6孔板中,待细胞贴壁后进行慢病毒感染,感染后48H,加入适量浓度的筛选药物puromycin(具体浓度通过药物筛选实验获得),24h后换液去除死细胞,继续传代维持培养。
注意事项:
1、病毒液应减少冻融次数,每一次冻融滴度会下降2-4,因此收毒时可进行分装以便后续使用。
2、转染时可加polybrene (可提高病毒转染效,需优化佳浓度(2–12 μg/ml))。
3、转染前先调整好细胞状态,收毒不宜太早,应在转染后48h之后收毒。
4、在进行实验时,可将培养皿中的细胞密度设置为4–5 x 10^6 cells/10 cm,若细胞分裂速率过快,可酌情减少铺板细胞数量,建议在细胞的汇合度达到50–80%时开始进行实验。
西安齐岳生物可提供的质粒构建服务包括:
(1)过表达质粒构建;
(2)诱导基因的定点突变;(单碱基突变,多碱基突变)
(3)构建基因截短体质粒;
(4)亚克隆质粒构建;
(5)通过慢病毒介导的基因过表达;
(6)通过构建shRNA慢病毒质粒实现基因的敲减
(7)通过CRISPR-Cas9技术实现基因敲除
注意事项:
本产品仅供科研使用,严禁用于人体或其他非科研用途。
使用过程中请佩戴手套和护目镜等防护用品,避免直接接触皮肤和眼睛。
请按照相关文献和相关安全规定进行操作,避免误用或滥用。如有侵权,可联系我们删除




 齐岳微信公众号
齐岳微信公众号 官方微信
官方微信 库存查询
库存查询