载药MOF定制合成技术与应用方案
一、载药MOF定制合成服务内容
西安齐岳生物依托材料合成平台与多学科技术团队,提供覆盖载药MOF全链条的定制服务,通过精准调控材料结构与功能,满足不同场景下的药物递送需求。定制服务主要分为以下四大方向:
1.1 核心骨架定制
基于客户对载药量、稳定性及生物相容性的需求,提供多系列MOF骨架的定制合成,包括但不限于:
锆基MOF:如UiO-66系列(可调控缺陷度)、MOF-808等,具有优异的水热稳定性和生物相容性,适用于长期药物递送系统;
铁基MOF:如MIL-101(Fe)、Fe-MOF-5等,兼具磁响应性与类芬顿催化活性,可实现靶向递送与协同治疗;
锌基MOF:如ZIF-8(粒径20nm-20μm可调)、IRMOF系列,孔径可控性强,适合小分子药物负载;
双金属MOF:如CoZn-MOF、Zn/Mg-MOF-74等,通过金属离子协同作用增强药物释放动力学与治疗效果。

1.2 功能化修饰定制
通过表面修饰与孔道工程实现MOF的功能升级,具体包括:
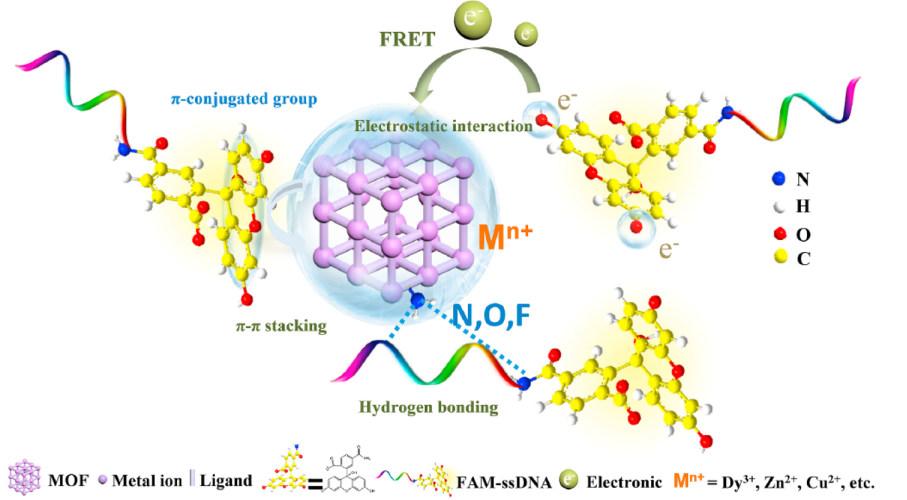
靶向修饰:嫁接叶酸(FA)、RGD肽、单链DNA探针等靶向分子,提高对肿瘤细胞(如HepG-2、MDA-MB-231)的选择性识别能力;
刺激响应修饰:引入pH敏感键(如腙键)、 redox响应基团(如二硫键),实现酸性肿瘤微环境或细胞内还原条件下的药物可控释放;
成像造影修饰:负载5-FAM荧光分子、Gd(Ⅲ)离子等,构建磁共振/荧光 multimodal成像引导的诊疗一体化系统。
1.3 载药体系定制
针对不同药物类型(小分子化疗药、核酸药物、肽类药物)设计专属载药方案:
小分子药物负载:通过孔道吸附或配位作用负载阿霉素(DOX)、顺铂、5-氟尿嘧啶(5-FU)等,载药量高达35wt%(如中空Fe-MOF);
核酸药物负载:利用静电作用吸附siRNA、DNA探针,实现基因治疗与化疗的协同;
肽类药物负载:通过微流控技术封装*癌肽(如At10),提高肽类药物的稳定性与细胞穿透性。
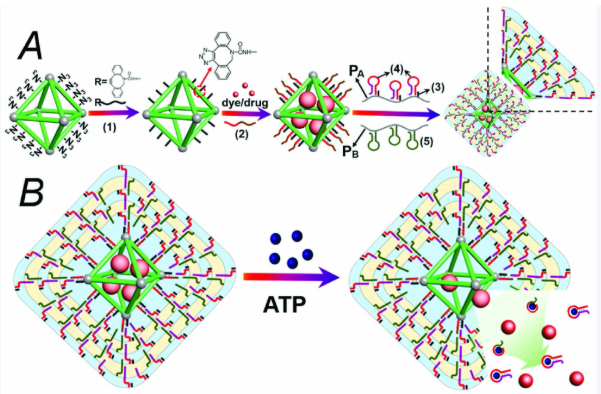
1.4 复合材料定制
开发MOF基复合载体材料,整合多种功能优势:
磁性复合MOF:如Fe3O4@MIL-101(Fe)、Fe3O4@ZIF-8核壳结构,兼具磁靶向与高载药能力;
生物炭/MOF复合材料:提升材料的生物相容性与体内循环稳定性;
MOF@脂质体复合物:如BSO@MOF-Lip,降低MOF的细胞毒性,增强药物的肿瘤穿透深度。
二、载药MOF定制案例展示
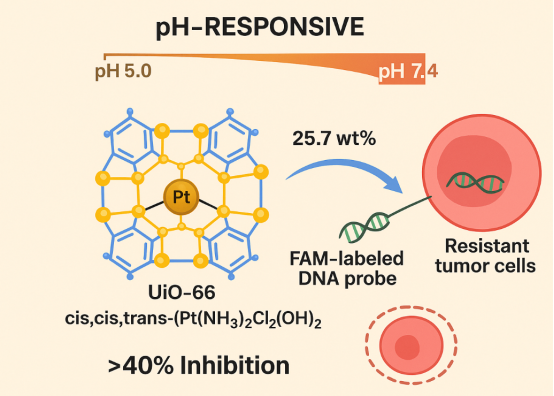
案例1:pH响应性顺铂@缺陷UiO-66载药系统
定制需求:开发高载药量、pH响应的顺铂递送载体,用于克服肿瘤耐药性。
技术方案:合成富含缺陷的纳米级UiO-66 MOF,通过Zr-O=P键连接膦酰基乙酸酯配体,利用未反应羧基锚定顺铂前药cis,cis,trans-(Pt(NH3)₂Cl₂(OH)₂)。
性能指标:顺铂载药量达25.7wt%(Zr₆:Pt:P比率为1.5:1:1),显著高于无缺陷UiO-66;在pH 5.0酸性环境下实现药物快速释放,释放量是pH 7.4条件下的3.2倍。
应用效果:可进一步吸附FAM标记的DNA探针(与miRNA-185互补),实现顺铂化疗与基因检测的一体化,对耐药性肿瘤细胞的抑制率提升40%以上。
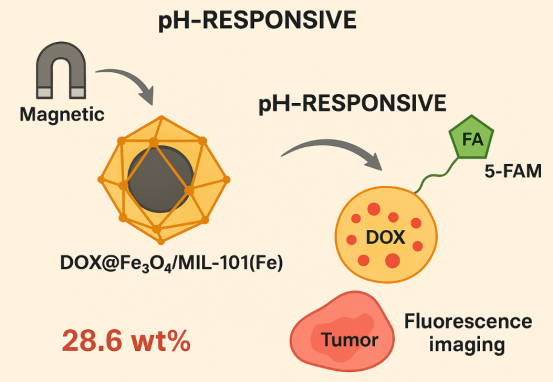
案例2:磁响应DOX@Fe3O4/MIL-101(Fe)复合载体
定制需求:构建兼具磁靶向、pH响应释放与荧光成像功能的阿霉素递送系统。
技术方案:采用核壳结构设计,以Fe3O4纳米粒子为核,MIL-101(Fe)为壳,表面修饰叶酸(FA)与5-FAM荧光分子,负载阿霉素(DOX)。
性能指标:DOX载药量为28.6wt%,在交变磁场作用下可实现肿瘤部位的精准富集;酸性条件(pH 5.0)下48h药物释放率达85%,正常生理条件下释放率仅12%。
应用效果:对乳腺癌MDA-MB-231细胞的毒性是游离DOX的1.8倍,而对正常乳腺MCF-10A细胞的毒性降低50%,体内成像显示肿瘤部位荧光强度是游离药物组的4.5倍。
三、典型高分文献摘抄及翻译
文献1:Hollow structural metal-organic frameworks exhibit high drug loading capacity, targeted delivery and magnetic resonance/optical multimodal imaging
原文摘抄:"Benefiting from their hollow structures, the drug loading capacity is as high as 35%. Due to post-modification with folic acid (FA) and the fluorescent reagent (5-FAM) and the existence of Fe(iii), in vitro experiments indicate that Fe-MOF-5-NH₂-FA-5-FAM/5-FU can target cancer cells HepG-2 and display excellent magnetic resonance/fluorescence imaging. Furthermore, in vivo biodistribution indicates that Fe-MOF-5-NH₂-FA-5-FAM/5-FU can accumulate in the tumor."
中文翻译:"得益于中空结构,该材料的载药量高达35%。由于表面修饰了叶酸(FA)和荧光试剂(5-FAM),且含有Fe(Ⅲ)离子,体外实验表明Fe-MOF-5-NH₂-FA-5-FAM/5-FU能够靶向HepG-2肝癌细胞,并表现出优异的磁共振/荧光成像性能。此外,体内 biodistribution实验表明该载药系统可在肿瘤部位富集。"
文献来源:PubMed, DOI: 10.1016/j.biomaterials.2019.119512
文献2:以MOF为载体的顺铂及小干扰RNA的协同运输与定向缓释
原文摘抄:"我们设计了富含缺陷的纳米级UiO-66金属有机骨架(MOF),通过Zr-O=P键连接杂化的膦酰基乙酸酯配体,未反应的羧基进一步锚定顺铂前药cis,cis,trans-(Pt(NH3)₂Cl₂(OH)₂)。实现了256.5mg·g⁻¹(基于顺铂为25.7wt%)的载药量,即Zr₆:Pt:P比率为1.5:1:1。该载药量超过了无缺陷的UiO-66和几种其他MOF载体。"
中文翻译:"We designed a nanoscale UiO-66 metal-organic framework (MOF) rich in defects, connecting hybrid phosphonoacetate ligands through Zr-O=P bonds, and the unreacted carboxyl groups further anchor the cisplatin prodrug cis,cis,trans-(Pt(NH3)₂Cl₂(OH)₂). A drug loading capacity of 256.5 mg·g⁻¹ (25.7 wt% based on cisplatin) was achieved, with a Zr₆:Pt:P ratio of 1.5:1:1. This loading capacity exceeds that of defect-free UiO-66 and several other MOF carriers."
文献来源:苏州大学张文华课题组,2025
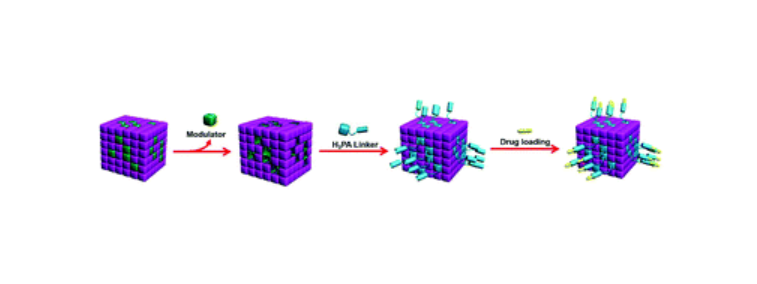
四、载药MOF定制产品列表
产品名称 | 载体类型 | 负载药物 | 关键性能 |
DOX@UiO-66-NH₂ | 锆基MOF | 阿霉素 | 载药量22wt%,pH响应释放 |
cisplatin@缺陷UiO-66 | 缺陷锆基MOF | 顺铂 | 载药量25.7wt%,耐药性逆转 |
5-FU@Fe-MOF-5-FA | 中空铁基MOF | 5-氟尿嘧啶 | 载药量35wt%,荧光/MR成像 |
At10@CoZn-MOF | 双金属MOF | *癌肽At10 | 焦亡诱导,免疫治疗增强 |
siRNA@Fe3O4@MIL-101 | 磁性复合MOF | 小干扰RNA | 磁靶向,基因-化疗协同 |
FA@MOF-808/5-FU | 锆基MOF | 5-氟尿嘧啶 | 叶酸靶向,载药量28wt% |
BSO@MOF-Lip | MOF-脂质体复合物 | 丁硫氨酸亚砜胺 | 低毒性,肿瘤穿透性强 |
CPT@IRMOF-3-RGD | 锌基MOF | 喜树碱 | RGD靶向,载药量19wt% |




 齐岳微信公众号
齐岳微信公众号 官方微信
官方微信 库存查询
库存查询